
Nowe trzy tomowe wydanie "Vademecum Technika Farmaceutycznego" wraz z pytaniami testowymi przygotowującymi do państwowego egzaminu zawodowego.
Niniejszy podręcznik kierowany jest do słuchaczy i absolwentów dwuletniego studium farmaceutycznego, którzy pragną przypomnieć sobie i uporządkować najważniejsze wiadomości przed egzaminem zawodowym. Z całą pewnością będzie również przydatny stażystom i osobom rozpoczynającym pracę w aptece lub przemyśle farmaceutycznym.Vademecum ujmuje materiał w formie notatek w taki sposób, aby maksymalnie ułatwić samodzielne uczenie się i dokształcanie. Treści uporządkowano według logiki przedmiotu. Jest to swoista pomoc dydaktyczna bogata w zestawienia tabelaryczne, podsumowania oraz schematyczne rysunki.
Do nabycia w naszym sklepie internetowym: kup teraz
Tańsze leki dla pacjentów i NFZ
List otwarty branży farmaceutycznej

Kilkudziesięciu sygnatariuszy, w tym organizacje pacjenckie i branża farmaceutyczna, podpisały list otwarty do Ministerstwa Zdrowia, apelując o tańsze i bardziej dostępne leki dla pacjentów. Sygnatariusze wezwali resort zdrowia do wykorzystania zbliżającej się nowelizacji ustawy refundacyjnej jako szansy na odblokowanie potencjału importu równoległego. List otwarty podpisano 14 października br. w Warszawie podczas XIII Forum Importu Równoległego. Sygnatariusze listu otwartego postulują m.in.: o uproszczenie i skrócenie procedur administracyjnych w ustawie refundacyjnej, likwidację zbędnych barier legislacyjnych, które w praktyce blokują rozwój importu równoległego oraz stworzenie jasnych i przewidywalnych zasad dla rozwoju importu równoległego w Polsce. Wdrożenie tego mechanizmu pozwoli na obniżenie kosztów terapii i ułatwi dostęp do leków nie tylko w aptekach, ale i w zakresie programów lekowych i leków w chemioterapii. Pod apelem podpisali się m.in. Federacja Pacjentów Polskich, Stowarzyszenie Importerów Równoległych Produktów Leczniczych, Federacja Konsumentów oraz Związek Pracodawców Hurtowni Farmaceutycznych.
Witamina D w ostatnich latach na dobre zagościła w świadomości pacjentów, głównie dlatego, że jej niedomiar wiąże się z wieloma chorobami, a znaczna część populacji cierpi na niedobory tego mikroelementu. Poświęcono jej wiele badań, analizując rolę w takich procesach jak homeostaza wapnia i metabolizm kości, w chorobach immunologicznych, infekcjach i nowotworach, chorobach układu krążenia, otyłości czy cukrzycy typu 2. Dane epidemiologiczne z 2020 r. pokazują, że 40% populacji Europy nie otrzymuje wystarczającej ilości witaminy D. Te wysokie liczby budzą niepokój. Najbardziej narażone grupy to: kobiety w ciąży, dzieci, osoby starsze, otyłe, o ciemniejszej karnacji oraz z ograniczoną ekspozycją na światło słoneczne [1].
Część zapotrzebowania na witaminę D organizm pokrywa poprzez syntezę z cholesterolu pod warunkiem odpowiedniej ekspozycji na światło słoneczne. Jednak trudno jest oszacować dawkę światła ze względu choćby na porę dnia, szerokość geograficzną i stosowanie filtrów przeciwsłonecznych. Niezbędne jest również odpowiednie spożycie witaminy D; je dobrymi źródłami mogą być tłuste ryby (np. łosoś i pstrąg) czy pełnotłuste produkty mleczne i margaryny [1].
Porządkując współczesne łacińskie nazwy botaniczne według ich pochodzenia, w ostatnim numerze (LwP nr 8/2025) przedstawiłam grupę nazw powstałych w starożytności w okresie klasycznym rozwoju języka greckiego i łacińskiego. W tym artykule zajmę się nazwami tworzonymi w okresach późniejszych aż do współczesności, w których budowie wykorzystano leksykę grecką i łacińską, tworząc zupełnie nowe wyrazy według reguł słowotwórczych języka łacińskiego. Nawiązują one bardzo często do różnych cech morfologicznych, właściwości leczniczych, miejsca występowania, długości cyklu życiowego, pory kwitnienia, koloru, smaku, zapachu czy toksyczności rośliny.
Tegoroczna Nagroda Nobla w dziedzinie fizjologii lub medycyny
Komentarze ekspertek i ekspertów centrum informacyjnego Tygodnia Noblowskiego Centrum Współpracy i Dialogu UW
Tegorocznymi laureatami Nagrody Nobla w dziedzinie fizjologii lub medycyny za odkrycia dotyczące obwodowej tolerancji immunologicznej zostali: Mary E. Brunkow, Fred Ramsdell i Shimon Sakaguchi.
–Tradycyjnie Komitet Noblowski nas zaskoczył, ale to, zdaje się, powtarzamy co roku jak mantrę. To wiedza na temat tolerancji układu odpornościowego, czyli jak to się dzieje, że nasz układ odpornościowy nie odpowiada nadmiernie na antygeny. Ma to kluczowe znaczenie dla zrozumienia podłoża chorób autoimmunologicznych, takich jak reumatoidalne zapalenie stawów czy szereg innych chorób autoimmunologicznych. Może nasze zaskoczenie wynika z tego, że jest to wiedza już dobrze ugruntowana w podręcznikach, na co Komitet Noblowski zwrócił uwagę. Szczególnie podkreślono rolę limfocytów T regulatorowych oraz genu FOXP3 w ich funkcjonowaniu – to podstawy immunologii – wyjaśnia dr hab. Edyta Brzóska-Wójtowicz, prof. ucz. (Instytut Biologii Rozwoju i Nauk Biomedycznych, Wydział Biologii UW).
Na nowej liście refundacyjnej, obowiązującej od 1 października, znalazły się preparaty do immunoterapii podjęzykowej dla dzieci w wieku 5–18 lat uczulonych na pyłki traw i brzozy oraz grupy 5–11 lat – w przypadku alergii na roztocze kurzu domowego. To długo wyczekiwana zmiana, która daje najmłodszym pacjentom z alergią dostęp do skutecznego i bardziej komfortowego leczenia – bez bólu i zbędnego stresu. Dotychczas refundacja tej formy terapii była dostępna jedynie dla starszych pacjentów. Młodsze dzieci miały do wyboru wyłącznie leczenie w formie zastrzyków, które wiązało się z bólem i koniecznością częstych wizyt w placówkach medycznych. Alergia u dzieci często ma złożony charakter – objawy pojawiają się jednocześnie, wzajemnie się nasilają, a dodatkowo komplikują je reakcje krzyżowe. Poważnym zagrożeniem jest także tzw. marsz alergiczny, czyli stopniowy rozwój choroby: od alergii wziewnych, przez kolejne schorzenia atopowe, aż po astmę.
– Dzięki decyzji o rozszerzeniu refundacji na immunoterapię podjęzykową dla dzieci alergolodzy mają do dyspozycji szerszy wachlarz narzędzi terapeutycznych. Taka terapia, prowadzona pod kontrolą specjalisty, jest skuteczną i bezpieczną metodą leczenia najmłodszych pacjentów. We właściwie dobranych przypadkach może zatrzymać marsz alergiczny i zmniejszyć ryzyko rozwoju cięższych postaci choroby w przyszłości. Dla dzieci oznacza to leczenie bez bólu i stresu związanego z iniekcjami, a dla lekarzy większą skuteczność i lepsze dopasowanie terapii – podkreśla prof. Karina Jahnz-Różyk, konsultant krajowa w dziedzinie alergologii.
Jednym z mechanizmów, który pozwala realnie obniżać koszty systemu ochrony zdrowia jest import równoległy leków. Według raportu „Wpływ importu równoległego na konkurencyjność na rynku leków w Polsce w latach 2019-2024” przygotowanego na zlecenie Stowarzyszenia Importerów Równoległych Produktów Leczniczych, dzięki importowi równoległemu w latach 2019-2024 polski system ochrony zdrowia zaoszczędził łącznie ponad 3,6 mld zło, w tym ponad 35,8 mln zł w grupie leków refundowanych. Są to środki, które można przekazać na inwestycje w system ochrony zdrowia, m.in. na nowoczesne terapie SMA oraz in vitro, wynagrodzenia medyków czy nowe karetki. Obecnie w resorcie zdrowia trwają prace nad nowelizacją ustawy refundacyjnej dotyczącej rynku farmaceutycznego, która jest szansą, by odblokować pełen potencjał oszczędności z importu równoległego.Dane do raportu przygotowała niezależna firma badawcza IQVIA.

25 września obchodzony jest Światowy Dzień Farmaceuty, a 26 września, w imieniny Kosmy i Damiana, którzy są patronami aptekarzy, obchodzony jest Ogólnopolski Dzień Aptekarza.
Z okazji tych wyjątkowych dni składamy wszystkim farmaceutom życzenia wielu sukcesów zawodowych, safysfakcji z wykonywania tak odpowiedzialnej i trudnej pracy, jaką jest codzienny kontakt z pacjentami, jak też uznania i docenienia kompetencji oraz coraz ważniejszej roli pełnionej w naszym systemie ochrony zdrowia.
Redakcja miesięcznika "Lek w Polsce" i Zarząd wydawnictwa Medyk
Międzynarodowy Dzień Chorób Siatkówki
24 września
Międzynarodowy Dzień Chorób Siatkówki ma na celu podnoszenie świadomości na temat chorób takich jak zwyrodnienie plamki związane z wiekiem (AMD) czy cukrzycowy obrzęk plamki (DME). Tego dnia rozpoczyna się również Retina Week – Międzynarodowy Tydzień Wiedzy o Chorobach Siatkówki Oka, obchodzony corocznie w ostatnim tygodniu września. Wczesna diagnoza i dostęp do nowoczesnych terapii dają realną szansę na zatrzymanie choroby i zachowanie widzenia na lata. Wciąż jednak tysiące pacjentów w Polsce leczonych jest starszymi metodami, mimo że nowoczesna medycyna pozwala na skuteczniejsze i bezpieczniejsze formy terapii i, co więcej, dostępne w programie lekowym.
W Polsce liczba pacjentów z AMD szacowana jest na ponad 140 tys. i ciągle rośnie. W obliczu starzejącego się społeczeństwa choroby siatkówki stają się jednym z największych wyzwań zdrowotnych w Polsce i na świecie. AMD rozwija się zazwyczaj po 50. r.ż., a ryzyko jej wystąpienia wzrasta wraz z wiekiem. W najbardziej agresywnej postaci, czyli wysiękowej (nAMD), może prowadzić do szybkiej i nieodwracalnej utraty widzenia centralnego.
– Niezdiagnozowane na czas choroby siatkówki są główną przyczyną utraty wzroku. Najgroźniejsze jest to, że przez długi czas nie dają żadnych objawów. A kiedy pacjenci zaczynają widzieć gorzej – często bywa już za późno, by w pełni uratować wzrok. Leczenie chorób plamki to wyścig z czasem. Na szczęście dzięki nowoczesnej medycynie ten wyścig możemy wygrać – podkreśla prof. Robert Rejdak, kierownik Katedry i Kliniki Okulistyki Uniwersytetu Medycznego w Lublinie, prezes Stowarzyszenia Chirurgów Okulistów Polskich.
Światowy Dzień Choroby Alzheimera
21 września
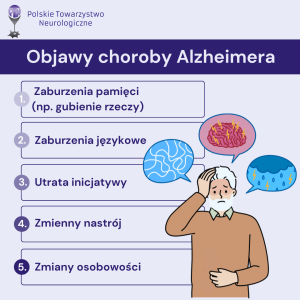
W Polsce, według różnych szacunków, żyje od 600 do nawet ponad 700 tys. osób cierpiących na choroby otępienne. Ministerstwo Zdrowia prognozuje, że w 2038 r. choroby otępienne będą dotyczyć aż 1,2 mln Polaków. Dynamiczny wzrost liczby chorych wynika z przemian demograficznych i starzenia się społeczeństwa, w tym związanych z nim występowaniem chorób towarzyszących, ale też zanieczyszczenia środowiska, niezdrowej diety i braku aktywności fizycznej. Najczęstszą przyczyna otępienia jest choroba Alzheimera, na którą cierpi około 360 tys. Polaków. Jest ona głównie diagnozowana u osób powyżej 65. r.życia, ale zapadają na nią również osoby znacznie młodsze, ok. 40. r.ż.
Choroba Alzheimera rozwija się podstępnie i długo może nie dawać żadnych wyraźnych objawów. Jej przyczyną jest gromadzenie się w mózgu nieprawidłowych białek, które prowadzą do utraty funkcji, a potem śmierci neuronów. Konsekwencją tego są zaburzenia tzw. wyższych czynności korowych, jak pamięć, orientacja, rozumienie, liczenie, mowa czy ocena sytuacji. Oprócz dysfunkcji poznawczych u osoby chorej dochodzi do zaburzeń zachowania, nastroju i osobowości. Znakami ostrzegawczymi są m.in.: zaburzenia językowe, zaburzenia pamięci, zmienny nastrój, zmiany osobowości, trudności w orientacji. Dostępne obecnie leczenie objawowe choroby Alzheimera jest tym skuteczniejsze, im wcześniej zostanie rozpoczęte, dlatego bardzo ważne jest szybkie reagowanie na takie objawy.

Skład: ekstrakt z bursztynu, proteiny jedwabiu i pszenicy, Moisture Booster.
W aptekach codziennie pojawiają się pacjenci z ranami – oparzeniami, otarciami, sączącymi się ranami pooperacyjnymi, a także z odleżynami czy stopą cukrzycową. To właśnie farmaceuci coraz częściej jako pierwsi udzielają im porady. Tymczasem, jak pokazują najnowsze wyniki ogólnopolskiego badania potrzeb farmaceutycznych w zakresie profesjonalnej terapii ran zrealizowanego w ramach kampanii „Rany pod kontrolą”, tylko 30% farmaceutów czuje się wystarczająco przygotowanych do profesjonalnej oceny i doboru produktów do leczenia ran. Aż 94,5% twierdzi, że brakuje im ustandaryzowanego algorytmu postępowania, a niemal 40% przyznaje, że nie ma wystarczającej wiedzy. Jednocześnie porad dotyczących terapii ran udzielają niemal wszyscy – 71% kilka razy w tygodniu, a 24% codziennie.
– Rana to nie jest temat drugorzędny – jeśli nie zostanie odpowiednio oceniona i zaopatrzona, może doprowadzić do zakażenia, a nawet amputacji. Jako farmaceuci mamy kontakt z tym problemem znacznie wcześniej niż system to zauważa. Pacjent nie pyta najpierw lekarza – pyta nas. Ale bez jasnych wskazówek, bez odpowiednich narzędzi, mimo posiadanej wiedzy, nasze działania nie są systemowo udokumentowane. To nie jest działanie systemowe ani sprawiedliwa sytuacja dla żadnej ze stron – mówi dr hab. n. med. i n. o zdr. Piotr Merks, przewodniczący Związku Zawodowego Pracowników Farmacji, ekspert kampanii 'Rany pod kontrolą".
Nowa lista leków refundowanych – od 1 października 2025 r.
Projekt obwieszczenia Ministra Zdrowia
Na liście leków refundowanych, która zacznie obowiązywać od 1 października tego roku, znalazło się 28 terapii nieonkologicznych oraz 22 onkologicznych. Zmiany dotyczą m.in. leków o ugruntowanej skuteczności, nowych terapii chorób rzadkich i ultrarzadkich, nowych technologii lekowych o wysokim poziomie innowacyjności refundowanych w ramach Funduszu Medycznego. Zmieniają się także wykazy bezpłatnych leków – w tym nowych szczepień w wykazie 65+.
– To nie tylko ostatnie ogłoszenie w tym roku, ale także historyczne. Na październikowej liście znalazła się rekordowa liczba terapii – refundacją objęto aż 50 nowych leków – powiedziała wiceminister zdrowia Katarzyna Kacperczyk.
Eksperci Ogólnopolskiego Programu Zwalczania Chorób Infekcyjnych przypominają, że wystarczy jedna wizyta u lekarza lub w aptece, aby zadbać o kompleksową ochronę zdrowia na cały sezon. Już od 25 sierpnia, zgodnie z obwieszczeniem Ministerstwa Zdrowia, każda osoba powyżej 18. r.ż. może bezpłatnie zaszczepić się przeciw grypie i RSV w aptece. Po otrzymaniu recepty po dwóch tygodniach warto również skorzystać ze szczepienia przeciw pneumokokom. To szybka, skuteczna i bezpieczna forma profilaktyki, która daje pełne zabezpieczanie przez zbliżającym się sezonem zachorowań.
Nowe dane Narodowego Instytutu Zdrowia Publicznego – PZH za styczeń–lipiec 2025 r. wskazują na istotny wzrost zachorowań na groźne infekcje układu oddechowego. Liczba zakażeń wirusem RSV wzrosła do 91 878 przypadków, co oznacza ponad 2,4-krotny wzrost w porównaniu do analogicznego okresu w roku ubiegłym. Zapadalność w populacji ogólnej wzrosła z 100,9 do 244,6 przypadków na 100 tys. mieszkańców. RSV wywołuje poważne powikłania również u dorosłych – szczególnie u osób powyżej 60. r.ż. oraz z osłabioną odpornością.
W ostatnich latach obserwuje się ogromny wzrost zainteresowania zastosowaniem agonistów glukagonopodobnego peptydu-1 (GLP-1RA), takich jak semaglutyd, szczególnie w kontekście utraty wagi. Co ósma osoba na świecie cierpi na otyłość, a leki z tej grupy stanowią przełom w jej terapii. Leki GLP-1RA spowalniają czas pasażu jelitowego w przewodzie pokarmowym i hamują apetyt, co może zaburzać wchłanianie składników odżywczych, prowadząc do niedoborów witamin i minerałów. Organizm nie otrzymuje niezbędnych składników odżywczych w odpowiedniej ilości, co uwydatnia w tym przypadku pilną potrzebę spersonalizowanego doradztwa dietetycznego. Dodatkowo działania niepożądane leków (mdłości, wymioty) mogą wpływać na preferencje żywieniowe pacjenta, w tym na ograniczenie spożycia konkretnych produktów.

- Szczepienia przeciw błonicy
- Zaburzenia neurologiczne związane z niedoborem wybranych witamin neurotropowych
- Immunoterapia alergenowa podjęzykowa – apel o rozszerzenie refundacji
- Franca, przymiot, kiła, syfilis – wiele nazw jednej choroby
- Dlaczego wykorzystanie bilastyny w terapii schorzeń alergicznych jest dobrym rozwiązaniem?
- Otyłość skraca życie
- Adrenalina może uratować życie
- Szczepienia w aptekach – potrzebne zmiany
- Zalecenia dietetyczne dla pacjentów z cukrzycą typu 2 i stanem przedcukrzycowym 2025
- Szczepienia przeciw błonicy
- Szałwia biała - potencjalne możliwości terapeutyczne
- Połączenie kwasu acetylosalicylowego, paracetamolu i kofeiny w łagodzeniu bólu głowy i migreny
- Nowe leki złożone zawierające semaglutyd w leczeniu otyłości
- Sok z imbiru jako źródło cennych składników o działaniu prozdrowotnym











